Konfigurasi Elektron

Sesuai dengan model atom Niels Bohr, elektron dalam atom berada pada tingkat energi tertentu. Tingkat energi dinyatakan dengan kulit atom dan disimbulkan dengan bilangan kuantum yang dimulai dengan bilangan bulat n= 1,2,3,…dst. Masing-masing dapat ditempati sejumlah elektron dengan rumus 2n^2

Konfigurasi elektron menggambarkan susunan elektron dalam orbital atom. Elektron yang berada di kulit paling luar tidak boleh lebih dari delapan. Banyaknya elektron yang berada di kulit terluar disebut elektron valensi yang dapat digunakan untuk menentukan letak golongan sedangkan jumlah kulit yang ditempati dapat digunakan menentukan periode unsur tersebut dalam Sistem Periodik Unsur. Beberapa kaidah yang harus dipatuhi dalam menentukan konfigurasi elektron.
a. Prinsip Aufbau
Pengaturan atau pengisian elektron dalam orbitalnya disusun berdasarkan tingkat energi yang dimulai dari tingkat energi yang rendah menuju ke tingkat energi yang tinggi. Prinsip ini dikenal dengan prinsip Aufbau yang artinya membangun. Tingkatan energinya sbb:
Pada saat pengisian elektron subkulit dengan tingkat energi diisi penuh dahulu kemudian sisanya menempati subkulit tingkat energi berikutnya dengan urutan sbb:
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s dst.

Pengisian orbital d pada kondisi khusus lebih stabil terisi penuh atau setengah penuh.

b. Aturan Hund
Pada tahun 1927 Frederick Hund menyatakan bahwa pengisian elektron pada sub orbital dengan jumlah orbital lebih dari satu maka diisi sesuai dengan tingkat energi yang sama dengan arah putaran yang sama. Maksudnya setiap orbital diisi satu-satu dahulu dengan arah putaran yang sama kemudian elektron sisanya diisikan berpasangan dengan arah putaran yang berlawanan.
Asas tersebut di atas mendasar pada penalaran bahwa energi tolak menolak antar dua elektron dapat diminimumkan jika jarak elektron berjauhan.
Contoh pengisian elektron pada atom nitrogen

c. Asas Larangan Pauli
Pauli menyatakan bahwa dalam satu atom tidak diizinkan dua elektron mempunyai keempat bilangan kuantum yang sama. Dengan kata lain setiap orbital maksimal hanya boleh diisi dua elektron dengan arah yang berlawanan atau spin yang berbeda. Contoh pengisian pada orbital ‘s’ diisi dengan dua elektron dengan spin yang berbeda seperti pada gambar berikut

Elektron maksimal yang boleh mengisi orbital hanya dua dengan alasan jika ada elektron yang ketiga maka akan memiliki spin atau arah putaran yang sama. Hal tersebut akan menyalahi larangan Pauli. Jumlah elektron maksimal untuk setiap sub kulit maksimal dua kali jumlah orbitalnya
Orbital s maksimum 2 elektron
Orbital p maksimum 6 elektron
Orbital d maksimum 10 elektron
Orbital f maksimum 14 elektron
d. Orbital
Orbital merupakan daerah kebolehjadian terbesar ditemukannya elektron. Bentuk orbital merupakan fungsi Ψ^2 dari fungsi gelombang Skrodinger.
Orbital shap (s)
Orbital yang paling sederhana yang hanya terdiri satu buah orbital yang berbentuk seperti bola. Elektron memiliki kerapatan yang sama, semakin jauh dari inti atom kerapatannya semakin berkurang. Semakin besar kuantum utamanya semakin besar pula ukuran orbitalnya.

Orbital p
Subkulit p memiliki 3 orbital yang sama dan memiliki tingkat energi yang sama. Perbedaannya terletak pada arah konsentrasi kepadatan elektron. Bentuk orbitalnya seperti balon terpilin dimana kerapatan elektron tidak tersebar secara merata. Elektron terkonsentrasi pada dua daerah yang terbagi sama besar dan terletak pada posisi saling berhadapan dari inti yang terletak di tengah.

Subkulit p memiliki bilangan kuantum magnetik yang berbeda yaitu -1, 0, +1
Orbital d
Orbital d memiliki 5 orbital dengan bentuk yang komplek dan orientasi yang berbeda-beda. Kelima orbital tersebut adalah dxy, dxz, dyz, dx^2y^2 dan dz^2
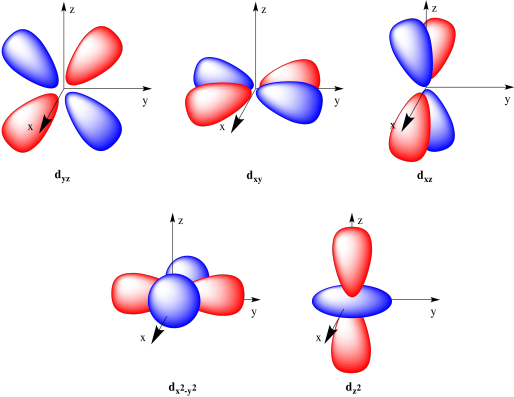
Orbital f
Subkulit f memiliki 7 orbital yang memiliki tingkat energi yang setara. Bentuk orbitalnya lebih rumit dan sangat kompleks.
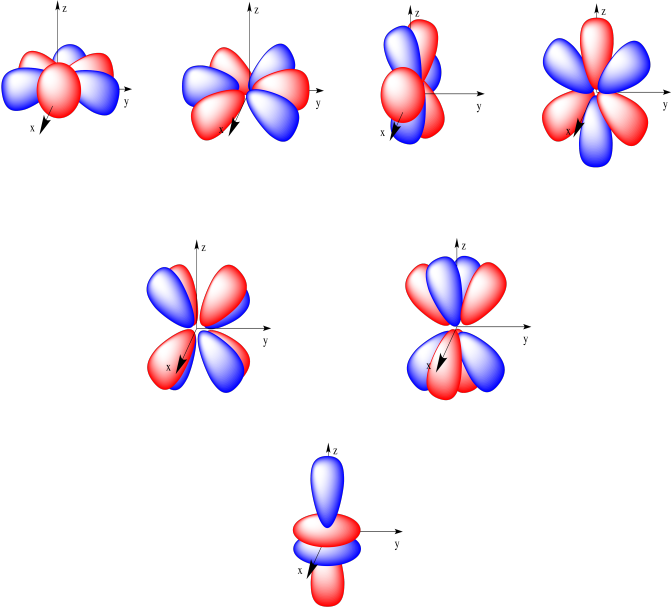
Orbital f dikelompokkan menjadi tiga kelompok yang rumit akan dipelajari lebih lanjut di kimia mekanika kuantum.
Penyimpangan Konfigurasi Elektron
Berdasarkan eksperimen, terdapat penyimpangan konfigurasi elektron dalam pengisian elektron. Penyimpangan pengisian elektron ditemui pada elektron yang terdapat pada orbital subkulit d dan f. Penyimpangan pada orbital subkulit d dikarenakan orbital yang setengah penuh (d5) atau penuh (d10) bersifat lebih stabil dibandingkan dengan orbital yang hampir setengah penuh (d4) atau hampir penuh (d8 atau d9). Dengan demikian, jika elektron terluar berakhir pada d4, d8 atau d9 tersebut, maka satu atau semua elektron pada orbital s (yang berada pada tingkat energi yang lebih rendah dari d) pindah ke orbital subkulit d.
Pada orbital f , sebagaimana dengan penyimpangan konfigurasi dalam orbital d, maka konfigurasi elektron yang berakhir pada orbital f juga mengalami penyimpangan. Penyimpangan dalam pengisian elektron dalam orbital ini disebabkan oleh tingkat energi orbital saling berdekatan hamper sama. Penyimpangan ini berupa berpindahnya satu atau dua elektron dari orbital f ke orbital d
Penulisan konfigurasi elektron pada ion
Penulisan konfigurasi elektron yang dijelaskan di atas berlaku pada atom netral. Penulisan konfigurasi elektron pada ion yang bermuatan pada dasarnya sama dengan penulisan konfigurasi elektron pada atom netral. Atom bermuatan positif (misalnya +x) terbentuk karena atom netral melepaskan elektron pada kulit terluarnya sebanyak x, sedangkan ion negatif (misalnya –y) terbentuk karena menarik elektron sebanyak y.
Penulisan konfigurasi elektronnya hanya menambah atau mengurangi elektron yang dilepas atau ditambah sesuai dengan aturan penulisan konfigurasi elektron. Ini berlaku untuk semua unsur yang membentuk ion, termasuk unsur transisi.

Semoga Manfaat ;)
Sumber gambar:https://employees.csbsju.edu/cschaller/Principles%20Chem/atoms/atomnumbers.htm
